
ПРИСОЕДИНЕНИЕ К КРАТНЫМ СВЯЗЯМ “С-С” АЛКЕНОВ, АЛКИНОВ И АЛКАДИЕНОВ |
Электрофильное присоединение
Алкены, алкадиены и алкины известны своей способностью легко реагировать с электрофильными реагентами, присоединяя их по кратным связям. В случае, если присоединяется СИММЕТРИЧНЫЙ реагент (такой, как Br2), затруднений в определении продуктов реакции не возникает. При избытке реагента происходит насыщение кратных связей и превращение алкенов – в дигалогеналканы, алкинов- в тетрагалогеналканы:

Однако, когда присоединяется несимметричный реагент (а таких подавляющее большинство) к несимметричному же алкену (или замещенному алкену), предсказать строение продукта становится сложнее. В ряде случаев присоединение происходит по правилу Марковникова:

Это происходит, если один из заместителей (или оба) при углеродах с кратной связью является электронодонорным: алкил-, метокси-, галоген- и т.п.).
Если заместитель электроноакцепторный (циано-, нитро-, сульфо-, карбокси-, карбонильная и т.п. группы), то присоединение протекает ПРОТИВ правила Марковникова:

В таких случаях для предсказания состава продукта следует рассматривать интермедиаты реакции- карбкатионы, и решать вопрос об их относительной стабильности. Образование продуктов происходит через превращения с наиболее устойчивым промежуточным карбкатионом:
Вопрос о сравнительной устойчивости карбкатионов решается просто. “Чисто” алкильные карбкатионы увеличивают устойчивость в ряду:
первичные < вторичные < третичные < аллильные, бензильные
Чем больше алкильных заместителей у положительно заряженного углерода, тем карбкатион устойчивей, вследствие нарастания компенсирующего заряд +I эффекта алкильной группы. Соответственно, следует учитывать влияние электроноакцепторных групп, таких, как:
-СООН, -СN, -CX3 (X-галоген), -C(=O)-R, -COOR, -NO2, -N=O, -SO3H и др. Любая из этих группировок, во-первых, затрудняет реакцию электрофильного присоединения в целом (обеднение электронной плотности С=С связи и дестабилизация карбкатиона), и во-вторых, приводит к образованию продуктов ПРОТИВ правила Марковникова:
Однако, группировки, имеющие на атоме, связанном с положительно заряженным углеродом карбкатиона, НЕПОДЕЛЕННУЮ пару электронов, увеличивают стабильность катиона, и вызывают образование продуктов присоединения по правилу Марковникова. К таким группировкам относятся: -О-, -ОН, -ОR, -NH2, -NHR, -NR2, -X (галоген), -SH, -SR и некоторые другие:
Схема компенсации положительного заряда мезомерным эффектом атома с неподеленной парой электронов выглядит так:
Несмотря на имеющийся у всех заместителей отрицательный индуктивный эффект –I (вследствие большей электроотрицательности), положительный мезомерный эффект (+M) в данном случае играет решающую роль.
Правила деления различных заместителей на группы, в зависимости от их электронных эффектов, приведены здесь.
Сопряженные алкадиены также дают разнообразие продуктов, вызванное делокализацией положительного заряда карбкатиона по системе негибридизованных р-орбиталей, в результате чего могут существовать два устойчивых карбкатиона одной структуры. Этим, в частности, объясняется повышенная устойчивость аллильных и бензильных карбкатионов.
Более устойчивый из двух карбкатионов может перемещать электронную плотность по системе сопряжения и образовать другой карбкатион:
Если нуклеофил (Br-, HO-, H2O и т.д.) прореагирует с карбкатионом I- получится продукт присоединения по типу 1,2; если с карбкатионом II- получится продукт 1,4- присоединения:
Суммируя сказанное, электрофильное присоединение по кратной связи можно охарактеризовать следующей краткой схемой:
СН3-С(СН3)2-CH=СН2 + Н+ ---- СН3-С(СН3)2-CH+-СН3 ---... --- СН3-С+(СН3)–CH(CH3)-СН3
Все сказанное относится к реакциям электрофильного присоединения. Следует помнить, однако, что присоединение HBr к алкенам, в зависимости от условий, может протекать как по механизму электрофильного присоединения, так и радикальным присоединением. Состав продуктов реакции полностью определяется механизмом ее протекания.
Радикальное присоединение
Радикальное присоединение к двойной связи С=С. Перекисный эффект.
Наиболее изучено открытое Харашем в 1932 году радикальное присоединение бромистого водорода, инициируемое следами перекиси и ингибируемое гидрохиноном. Открытие механизма радикального присоединения к двойным связям положило конец противоречиям, наблюдаемым у многочисленных исследователей при присоединении бромистого водорода к несимметричным алкенам: у одних эта реакция приводила к продуктам присоединения против правила Марковникова, у других- по правилу Марковникова, у третьих получалась смесь продуктов. Всему виной оказалось то, что у разных исследователей реакции протекали в различных условиях (и, соответственно, по различным механизмам), что и приводило к неоднозначным продуктам. При проведении реакции в условиях, характерных для протекания цепных процессов (газовая фаза, в индифферентном растворителе при освещении, присутствие следов перекисей) в качестве интермедиатов образуются радикалы:
H-Br --- H. +
(либо: а) R-O-O-R ---- 2 R-O.
б) H-Br + R-O. ---- R-OH +
Далее протекает реакция с алкеном, причем алкен атакуется радикалом галогена:

Реакция завершается взаимодействием более стабильного радикала полупродукта со «свежей молекулой» HBr, при этом регенерируется радикал Br..
Цепная реакция обрывается в результате диспропорционирования радикалов, либо при взаимодействии с молекулами ингибиторов:

Ряд устойчивости радикалов аналогичен ряду устойчивости карбкатионов:
Первичные < вторичные < третичные << аллильные, бензильные
Хлористый водород также может быть присоединен радикальным процессом (для этилена реакция инициируется ультрафиолетовым светом или перекисью трет-бутила при 140 С). Реакция присоединения HCl к трет-бутил-этилену (протекающая против правила Марковникова) инициируется перекисью бензоила. Вообще, реакции присоединения HCl к олефинам идут короткими цепями, сопровождаясь побочными процессами, например теломеризацией (образованием олигомеров).
В газовой фазе или индифферентном растворителе при освещении можно провести цепные реакции хлорирования или бромирования алкенов и ацетилена. В итоге получаются те же продукты, что и при обычном электрофильном присоединении. Иод присоединяется к алкенам при освещении при температуре -55 С. К алкенам присоединяются по радикальному механизму также и меркаптаны (R-SH) в присутствии инициаторов радикальных цепных реакций. Присоединение протекает против правила Марковникова.
К алкенам присоединятся по радикальному механизму (в присутствии перекисей ацилов) также полигалоидные алканы- CCl4, CHCl3, CCl3Br и другие. Инициаторы отрывают от молекулы полигалоидного алкана атом галогена или водорода (ряд легкости отрыва: J > Br > Cl). Водород в CHCl3 отрывается легче Cl.

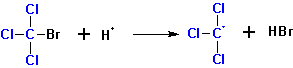
Далее протекает радикальное присоединение:
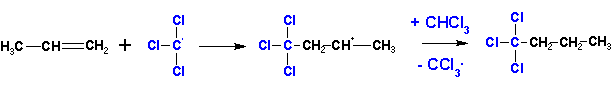

Таким образом, CHCl3 присоединяется как CCl3-H, а CCl4- как CCl3-Cl.